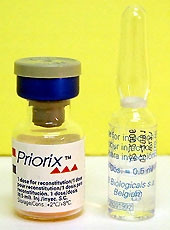
Thông tin từ Cục Y tế dự phòng (Bộ Y tế) cho biết: Hiện có một số trường hợp trẻ từ 13-16 tháng tuổi vào Bệnh viện Nhi đồng 1 do có các biểu hiện sốt cao, sưng tấy tại chỗ tiêm và nghi nhiễm khuẩn huyết sau tiêm vaccine Priorix phòng sởi, quai bị, rubella tại quận 5, TP Hồ Chí Minh.
Đây là loại vaccine do hãng GlaxoSmithKline sản xuất lô số A69CA409A, sản xuất tháng 8-2005 có hạn sử dụng đến hết tháng 7-2007. Để đảm bảo an toàn tiêm phòng vaccine cho nhân dân, Cục Y tế dự phòng Việt Nam đã đề nghị Sở Y tế các tỉnh thành phố khẩn trương chỉ đạo: Tạm ngừng ngay việc tiêm vaccine Priorix phòng sởi, quai bị, rubella do hãng GlaxoSmithKline sản xuất cho tới khi Bộ Y tế thông báo tiếp tục sử dụng loại vaccine này; tăng cường việc khám kiểm tra tiêm phòng vaccine, nguồn gốc, chủng loại vaccine tiêm dịch vụ trên địa bàn, chất lượng vaccine, dây chuyền lạnh, hạn sử dụng, kỹ thuật tiêm phòng; tăng cường chỉ đạo các biện pháp sử dụng vaccine an toàn và các bước an toàn thực hiện trong tiêm phòng các loại vaccine trên địa bàn. Chuẩn bị các điều kiện để sơ cấp cứu ban đầu, chống sốc phản vệ và điều trị bệnh nhân kịp thời.
Bộ Y tế cũng yêu cầu các cơ sở có tiêm chủng cũng phải hết sức cẩn trọng trong tất cả các khâu liên quan đến tiêm phòng vaccine như vận chuyển, bảo quản, quy trình tiêm chủng, phòng chống sốc và choáng. Theo các chuyên gia y tế, hiện chưa thể đưa ra một phán đoán nào về nguyên nhân gây sốc, hôn mê và tử vong cho những trẻ đã tiêm Triorix.
Loại vaccine này đã được sử dụng khá lâu ở Việt Nam với số lượng rất lớn, nhưng chưa bao giờ xảy ra tai biến. Tại Việt Nam, cũng chưa có trường hợp tương tự xảy ra với tất cả các loại vaccine. Do vậy nhiều chuyê gia cho rằng, việc tìm nguyên nhân gây ra các vụ tai biến trên sẽ rất phức tạp, cần sự nhập cuộc của các chuyên gia trên nhiều lĩnh vực, từ những cán bộ y tế cơ sở trực tiếp tiêm, các bác sĩ lâm sàng có kinh nghiệm trong chẩn đoán tai biến liên quan đến tiêm chủng trẻ em, chuyên gia kiểm định vaccine đến cán bộ giám định pháp y (nếu có tử vong).
Vaccine Priorix.
Các mẫu vaccine, ống tiêm và kim tiêm đã được sử dụng cho nạn nhân hoặc trong cùng lô đều phải được kiểm định. Để bảo đảm an toàn cho trẻ khi tiêm chủng, các chuyên gia về y tế đã đưa lời khuyến cáo: các bậc cha mẹ khi đưa con đi tiêm phải nói rõ tình trạng sức khỏe của con cho cán bộ y tế, khai đầy đủ tiền sử dị ứng và các vaccine vừa sử dụng nếu có; sau khi tiêm bất cứ thuốc gì, tốt nhất là không về nhà ngay mà phải có thời gian theo dõi phản ứng để có thể xử trí kịp thời; với cán bộ y tế, cần hỏi kỹ các thông tin về bệnh nhân, thực hiện đủ các khâu thử phản ứng, theo dõi phòng chống sốc sau tiêm đúng như quy định.
Được biết, đến 14 giờ chiều ngày 11-5, tại Khoa Hồi sức -Bệnh viện Nhi Đồng 1 vẫn còn 5 trẻ đang trong tình trạng thở máy do bị sốc thuốc sau khi tiêm vaccine Priorix ngừa quai bị-sởi-rubella.
* Ba trẻ bị tai biến do tiêm vaccine phòng sởi - quai bị - rubella
| Đại diện GlaxoSmithKline Việt Nam: Hợp tác giải quyết sự cố Sau khi sự việc xảy ra, bác sĩ Nguyễn Thị Tường Vi - Giám đốc bộ phận vaccine thuộc văn phòng đại diện của Tập đoàn GlaxoSmithKline (GSK) tại Việt Nam - đơn vị sản xuất loại vaccine này, đã có cuộc trao đổi như sau: - PV: Vaccine Priorix được sản xuất, bảo quản và lưu hành tại Việt Nam ra sao? GSK có tham gia kiểm tra việc bảo quản? - Bác sĩ Nguyễn Thị Tường Vi: Nằm trong 15 loại vaccine đã lưu hành trên 168 quốc gia (trong đó có 7 loại đã được phép lưu hành tại Việt Nam), vaccine Priorix cũng phải đáp ứng các tiêu chuẩn chất lượng toàn cầu. Trong đó, quy trình sản xuất, đóng gói, vận chuyển (từ nhà máy tại Bỉ đến các kho hải quan các nước, kho của các nhà phân phối) đều được bảo đảm dây chuyền lạnh nghiêm ngặt 2 - 8 độ C. Bản thân các đơn vị liên quan đến việc nhập khẩu, phân phối vaccine Priorix ở Việt Nam như: Công ty dược phẩm Sapharco, Công ty Zuellig Pharma và Công ty Hoàng Đức (đơn vị trung chuyển ngắn hạn) đều có hệ thống kho lạnh đạt chất lượng và được GSK kiểm tra thường xuyên và nghiêm ngặt. Sau đó, vaccine được cung cấp cho các hệ thống y tế dự phòng, các trung tâm y tế- là những đơn vị chuyên nghiệp trong hệ thống tiêm chủng quốc gia. Ở phần này, việc kiểm soát công tác bảo quản vaccine, kỹ thuật tiêm ngừa, vô trùng bơm kim tiêm cũng như các vấn đề liên quan khác nằm ngoài tầm tay của chúng tôi. - Dù nguyên nhân gây tai biến cho một số trẻ tiêm chủng chưa được xác định, nhưng ở góc độ nhà sản xuất vaccine, nhận định và phản ứng của GSK về vấn đề này như thế nào? - Trường hợp này là cực kỳ hiếm và tai biến nghiêm trọng xảy cùng lúc là rất đáng quan tâm, cần xem xét, phân tích một cách khẩn trương, toàn diện và cẩn trọng. Một mặt GSK đã theo sát diễn biến sự việc và đề xuất với các đơn vị y tế có liên quan để có thể tham gia ở mức tốt nhất vào việc hỗ trợ cứu chữa cho bệnh nhân. Một mặt, chuyên gia về y khoa và an toàn vaccine của tập đoàn GSK sẽ có mặt tại Việt Nam trong ngày 11-5, với cam kết cải thiện chất lượng cuộc sống con người, chúng tôi mong muốn được hợp tác các cơ quan chức năng của Việt Nam sớm xác định được nguyên nhân gây ra sự cố nói trên. |